Summary
বাস্তব গ্যাসের সংকোচনশীলতা গুণাঙ্ক (Compressibility Factor)
সংকোচনশীলতা গুণাঙ্ক \( Z \) বাস্তব গ্যাসের আচরণকে আদর্শ গ্যাস থেকে আলাদা করতে ব্যবহৃত হয়।
- Z = 1 হলে গ্যাস আদর্শ গ্যাসের মতো আচরণ করে।
- Z > 1: অণুগুলোর মধ্যে বিকর্ষণ বল কার্যকর।
- Z < 1: অণুগুলোর মধ্যে আকর্ষণ বল কার্যকর।
পেষণ গুণাঙ্ক (Compressibility)
পেষণ গুণাঙ্ক গ্যাসের সংকোচন ক্ষমতার পরিমাপ। এটি উচ্চ চাপ ও নিম্ন তাপমাত্রায় পরিবর্তিত হয় এবং আদর্শ গ্যাসের তুলনায় মান অনেক কম বা বেশি হতে পারে।
আদর্শ গ্যাস
- আদর্শ গ্যাসে অণুগুলোর মধ্যে আকর্ষণ বা বিকর্ষণ বল নেই।
- গ্যাসের আচরণ বোইলস এবং চার্লসের নিয়ম অনুসরণ করে।
আদর্শ গ্যাস সমীকরণ
PV = nRT (যেখানে P: চাপ, V: আয়তন, T: তাপমাত্রা, n: মোল সংখ্যা, R: গ্যাস ধ্রুবক)
বাস্তব ও আদর্শ গ্যাসের পার্থক্য
বাস্তব গ্যাসে অণুর মধ্যে আকর্ষণ ও বিকর্ষণ বল থাকে, যা আদর্শ গ্যাসে নেই। বাস্তব গ্যাসের সংকোচনশীলতা গুণাঙ্ক Z আদর্শ গ্যাসে ১ হয়, কিন্তু বাস্তব গ্যাসে তা ১-এর সমান নয়।
সারাংশ
বাস্তব গ্যাসের আচরণ সংকোচনশীলতা গুণাঙ্ক এবং পেষণ গুণাঙ্কের মাধ্যমে ব্যাখ্যা করা হয়, যা চাপ ও তাপমানের উপর নির্ভরশীল।
বাস্তব গ্যাসের সংকোচনশীলতা গুণাঙ্ক (Compressibility Factor)
সংকোচনশীলতা গুণাঙ্কের ধারণা
বাস্তব গ্যাসের আচরণকে আদর্শ গ্যাস থেকে পৃথক করতে সংকোচনশীলতা গুণাঙ্ক \( Z \) ব্যবহার করা হয়। এটি গ্যাসের প্রকৃত চাপ-আয়তন-তাপমাত্রার সম্পর্কের মাপকাঠি।
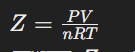
যেখানে, Z = 1 হলে গ্যাসটি আদর্শ গ্যাসের মতো আচরণ করে।
বাস্তব গ্যাসে Z -এর গুরুত্ব
- Z > 1 : গ্যাসের অণুগুলোতে বিকর্ষণ বল বেশি কার্যকর।
- Z < 1 : গ্যাসের অণুগুলোতে আকর্ষণ বল বেশি কার্যকর।
বাস্তব গ্যাসে সংকোচনশীলতা গুণাঙ্ক গ্যাসের পৃষ্ঠের অবস্থা এবং চাপ-তাপমাত্রার ওপর নির্ভর করে।
পেষণ গুণাঙ্ক (Compressibility)
পেষণ গুণাঙ্কের সংজ্ঞা
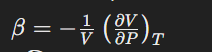
পেষণ গুণাঙ্ক গ্যাসের সংকোচন ক্ষমতার পরিমাপ। এটি নির্ণয় করা হয় নিচের সমীকরণে:
এটি গ্যাসের আকার সংকোচনের হার নির্দেশ করে।
পেষণ গুণাঙ্ক ও বাস্তব গ্যাস
উচ্চ চাপ এবং নিম্ন তাপমাত্রায় বাস্তব গ্যাসের পেষণ গুণাঙ্ক উল্লেখযোগ্যভাবে পরিবর্তিত হয়। এটি আদর্শ গ্যাসের গুণাঙ্কের তুলনায় অনেক কম বা বেশি হতে পারে।
আদর্শ গ্যাস
আদর্শ গ্যাসের বৈশিষ্ট্য
আদর্শ গ্যাস এমন একটি কাল্পনিক গ্যাস, যার অণুগুলো
- পরস্পরের ওপর কোনো আকর্ষণ বা বিকর্ষণ বল প্রয়োগ করে না।
- নিজস্ব আকার বা আয়তন নেই।
- গ্যাসের আচরণ বোইলস এবং চার্লসের নিয়ম মেনে চলে।
আদর্শ গ্যাস সমীকরণ
আদর্শ গ্যাস সমীকরণ হলো:
PV = nRT
যেখানে,
P : চাপ, V : আয়তন, T : তাপমাত্রা, n : মোল সংখ্যা, R : গ্যাস ধ্রুবক।
বাস্তব ও আদর্শ গ্যাসের পার্থক্য
- বাস্তব গ্যাসে অণুর মধ্যে আকর্ষণ ও বিকর্ষণ বল থাকে, যা আদর্শ গ্যাসে অনুপস্থিত।
- বাস্তব গ্যাসের সংকোচনশীলতা গুণাঙ্ক Z আদর্শ গ্যাসের ক্ষেত্রে ১ হয়, কিন্তু বাস্তব গ্যাসে তা ১-এর সমান নয়।
সারাংশ
বাস্তব গ্যাসের সংকোচনশীলতা গুণাঙ্ক ও পেষণ গুণাঙ্কের মাধ্যমে তাদের আচরণ ব্যাখ্যা করা হয়, যা আদর্শ গ্যাসের তুলনায় ভিন্ন। বাস্তব গ্যাসের গুণাবলী চাপ ও তাপমাত্রার উপর নির্ভর করে পরিবর্তিত হয়।
Read more






